Trasplante de corazón y circulación asistida a mediano y largo plazo
-
Trasplante de corazón y circulación asistida a mediano y largo
La insuficiencia cardíaca avanzada o terminal constituye una secuela cada vez más frecuente de la identificación y utilización amplia de medidas cada vez más eficaces aplicadas tanto a la paliación de las etapas iniciales de las cardiopatías como a evitar la muerte repentina que pueden causar. Al identificar a una persona con insuficiencia cardíaca terminal o refractaria, el médico debe escoger entre proponer medidas humanitarias para mejorar la calidad de vida hasta la muerte o recomendar medidas heroicas para prolongar la existencia. En el caso de la persona relativamente joven y sin más enfermedades graves, la segunda pudiera ser una opción razonable. Las opciones terapéuticas actuales se limitan al trasplante de corazón (con la opción de asistencia mecánica como un lapso de espera o intermedio hasta el trasplante), pero no está muy lejana la opción de asistencia mecánica permanente de la circulación.
Trasplante de corazón
En el decenio de 1960 se crearon técnicas operatorias para el trasplante ortotópico del corazón, que comenzaron a aplicarse a la práctica clínica en 1967. Tal metodología no tuvo aceptación clínica muy amplia antes de 1985, época en que se introdujo la inmunodepresión “moderna”, más eficaz. En el decenio de 1990, las solicitudes para obtener un corazón para trasplante igualaron el número disponible de órganos donados y después lo rebasaron, hasta alcanzar un punto máximo de 4 400 corazones donantes cada año en todo el mundo para esas fechas (antes de 1995) y disminuir a unos 3 000 órganos en 2002.
Técnica operatoria
Se extraen el corazón del donante y el del receptor en operaciones casi idénticas, en que se efectúan incisiones en las aurículas y el tabique interauricular al nivel mesoauricular (se deja en su sitio la porción posterior de la aurícula) y el corte abarca los grandes vasos exactamente por arriba de las válvulas semilunares. El corazón donado por lo común se obtiene por métodos anatómicos, idénticos, tarea que realiza un segundo grupo quirúrgico, y la pieza es transportada desde el hospital en que se extrajo, dentro de un recipiente con solución salina helada, hasta unirla mediante anastomosis al receptor, en una posición anatómica ortotópica normal. La única modificación de la técnica operatoria en años recientes, desde que se describió originalmente, ha sido cambiar la anastomosis auricular derecha, hasta el nivel de las venas cavas superior e inferior, a fin de conservar mejor la geometría de dicha cavidad (aurícula derecha) y evitar arritmias auriculares. El método mencionado de implante deja al receptor con el corazón quirúrgicamente desnervado que no reacciona a los estímulos simpáticos o parasimpáticos directos, pero sí lo hace a las catecolaminas de la sangre circulante. Las respuestas fisiológicas del corazón desnervado a las exigencias que impone el ejercicio son atípicas, pero aun así, adecuadas para lograr una actividad física normal.
Sistema de asignación de órganos donados
En Estados Unidos, la asignación de órganos donados se hace bajo la supervisión de the United Network for Organ Sharing (UNOS), organización privada que labora bajo contrato con el gobierno federal. Para la asignación de corazones donados, el país se ha dividido en 11 regiones geográficas. La asignación del órgano donado dentro de una región se decide con arreglo a un sistema de prioridades que toma en consideración: 1) la gravedad de la enfermedad; 2) la distancia geográfica desde el sujeto donante, y 3) el tiempo que ha estado el enfermo en la lista de espera. El límite fisiológico de unas 3 h de “isquemia” (lapso en que el corazón está fuera del cuerpo) impide la cobertura nacional de la demanda de corazones para aloinjerto. El diseño del sistema mencionado se renueva cada año, teniendo en cuenta los aportes de diversos elementos que lo constituyen, como las familias de los donantes y los trasplantólogos profesionales.
En la actualidad, se asigna la máxima prioridad basada en la gravedad de la enfermedad sólo a los sujetos que necesitan hospitalización para apoyo inotrópico intravenoso, con un catéter en arteria pulmonar para la vigilancia hemodinámica o sin esta última. Todos los demás enfermos tienen prioridad con arreglo al lapso que han estado en la lista de espera y la concordancia se decide sólo a partir de la compatibilidad del grupo sanguíneo ABO y también la de la talla corporal aproximada.
Indicaciones y contraindicaciones
La insuficiencia cardíaca es una causa cada vez más frecuente de muerte, particularmente en los ancianos. Casi todos los enfermos que han alcanzado la llamada categoría de la etapa D, es decir insuficiencia terminal refractaria, son tratados de manera adecuada con medidas humanitarias hasta que mueren (cuidados paliativos). Un subgrupo de esos pacientes, más jóvenes y que no tienen otras enfermedades notables coexistentes, pudiera considerarse elegible para el trasplante de corazón. Los criterios exactos varían de un centro a otro, pero por lo común toman en consideración la edad fisiológica de la persona y la existencia de otras enfermedades como las de tipo periférico o cerebrovasculares, obesidad, diabetes, cáncer o infección crónica.
Resultados
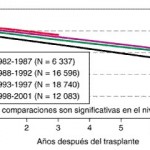
El registro organizado por the International Society for Heart and Heart-Lung Transplantation ha recopilado desde 1982 a nivel mundial y en Estados Unidos las tasas de supervivencia después de trasplante de corazón. La actualización más reciente indica una supervivencia de 83 y 76%, uno y tres años después del trasplante, o un promedio de vida después del injerto de 9.3 años (fig. 217-1). La calidad de vida de los operados por lo común ha sido excelente y más de 90% de los enfermos incluidos en el registro han recuperado sus funciones normales y sin limitaciones después del trasplante.
Supervivencia actuarial de personas con trasplante cardíaco, en operaciones realizadas entre 1982 y 2001, según la era de los trasplantes. (Con autorización de United) Network for Organ Sharing/International Society for Heart and Heart-Lung Transplantation Registry.
Inmunodepresión
Los regímenes médicos utilizados para suprimir la reacción inmunitaria normal a un órgano sólido implantado como aloinjerto varían de un centro a otro y están en evolución constante, conforme se introducen agentes más eficaces con mejores perfiles de reacciones adversas y menores efectos tóxicos. Todos los regímenes utilizados son inespecíficos y logran una hiporreactividad general a los antígenos heterólogos y no una hiporreactividad con especificidad de donante y todos causan la predisposición concomitante, e indeseable, a infecciones y cánceres. Casi todos los programas de trasplante de corazón utilizan un régimen con tres fármacos que comprende un inhibidor de calcineurina (ciclosporina o tacrolimo), un inhibidor de la proliferación o la diferenciación de linfocitos T (azatioprina, mofetil de micofenolato o sirolimo) y por lo menos un ciclo inicial breve de glucocorticoides. Muchos programas también incluyen un ciclo de inducción inicial con anticuerpos monoclonales o policlonales contra los linfocitos T en el período perioperatorio, a fin de disminuir la frecuencia o la intensidad de rechazo temprano después del injerto. Entre los anticuerpos monoclonales de introducción más reciente están daclizumab y basiliximab, que bloquean al receptor de interleucina-2 y pueden evitar el rechazo del aloinjerto, sin originar una inmunodepresión global adicional.
El diagnóstico de rechazo del aloinjerto de corazón por lo común se hace por medio de la biopsia endomiocárdica, en general como parte de un sistema de vigilancia, o en respuesta al deterioro clínico. Las medidas correctoras idóneas consisten en intensificar la inmunodepresión, cuya duración y gradación dependen de la intensidad del rechazo.
Problemas de tratamiento de la fase tardía después del trasplante
Un número creciente de personas con corazones injertados viven años después de la operación y así constituyen una población con problemas de tratamiento a largo plazo.
Arteriopatía coronaria en el aloinjerto
A pesar de que el corazón donado proviene de personas jóvenes, quienes reciben un aloinjerto tienden a desarrollar enfermedad de arterias coronarias (coronary, CAD); por lo regular, se trata de un trastorno difuso, concéntrico artery disease y longitudinal, muy distinto al de CAD ateroesclerótica “convencional”, que es más focal y a menudo excéntrica. La causa primaria muy probablemente sea la lesión inmunitaria del endotelio vascular, pero su existencia y evolución son influidas por muy diversos factores de riesgo. Se espera que las modalidades inmunodepresoras más nuevas y mejores disminuyan la incidencia y la trascendencia de estas complicaciones devastadoras, que explican la mayor parte de los fallecimientos en etapas tardías después del trasplante. La paliación de la enfermedad por medio de intervenciones percutáneas quizá incluya maniobras seguras y eficaces a corto plazo. A causa de la desnervación del corazón injertado, las personas rara vez sufren angina de pecho, ni siquiera en etapas avanzadas de la enfermedad.
En el caso de CAD avanzada del aloinjerto, un nuevo trasplante sería la única forma definitiva de tratamiento, pero las cifras de menor supervivencia después del nuevo injerto y la escasez de corazones para injertar dificultan en grado sumo ese segundo intento en el paciente individual y también surgen problemas éticos.
Cánceres
La mayor incidencia de cánceres constituye una secuela identificada de cualquier programa de inmunodepresión a largo plazo y el trasplante de órganos no es la excepción. Entre las complicaciones más frecuentes después del injerto están las enfermedades linfoproliferativas, que en muchos casos parecen haber sido desencadenadas por el virus de Epstein-Barr. El tratamiento eficaz consiste en disminuir la inmunodepresión (sin duda una “espada de doble filo”, en el marco de un órgano del que depende la vida), agentes antivíricos y la quimioterapia y radioterapia tradicionales. En fecha reciente han sido muy promisorios los intentos hechos con fármacos antilinfocíticos específicos (CD20). En personas que han recibido trasplantes también se observa una mayor frecuencia de cánceres de la piel (carcinomas de células basales y pavimentosas) y su evolución puede ser muy agresiva. No se ha precisado la utilidad que tendría disminuir la intensidad de la inmunodepresión para tratar dichos cánceres.
Infecciones
El empleo de las modalidades inmunodepresoras inespecíficas con que se cuenta para evitar el rechazo del aloinjerto origina naturalmente una mayor predisposición a las complicaciones infecciosas en la persona que las recibe. La incidencia de tal complicación ha disminuido desde que se introdujo la ciclosporina, pero las infecciones por microorganismos poco comunes y oportunistas siguen siendo la causa principal de muerte en el primer año después de la operación y subsisten como una amenaza para el individuo que necesita inmunodepresión permanentemente durante toda su vida. El tratamiento eficaz depende de la vigilancia cuidadosa en busca de signos y síntomas tempranos de infecciones por oportunistas y una estrategia extraordinariamente intensiva para llegar a un diagnóstico específico y también el concurso de expertos que identifiquen los cuadros iniciales más frecuentes de infecciones por citomegalovirus, Aspergillus y otros agentes oportunistas infecciosos.




















Comentarios