Proteínas
-
Proteínas
La palabra tiene su origen en el término griego proteios, que quiere decir lo principal o lo más importante. Se trata de las biomoléculas más importantes, que fueron descubiertas por Berzelier en 1838 y posteriormente descritas por Mulder.
Pueden desempeñar muchas funciones que dependen sobre todo de la cadena de aminoácidos que las compone.
Existen diferentes clasificaciones de las proteínas:
I. COMPOSICIÓN
- Simples: después de realizar una hidrólisis de la proteína únicamente podemos encontrar aminoácidos.
- Conjugadas: al realizar la hidrólisis encontramos junto a los aminoácidos diversas sustancias que son los conocidos como los grupos prostéticos.
- Dependiendo de la sustancia que encontremos hablamos de:
- Lipoproteínas, si están unidas a lípidos. Dentro de este grupo podemos encontrar: QM - VLDL - LDL - IDL - HDL.
- Nucleoproteínas, si está unidas a histonas.
- Glucoproteínas, si están unidas a algún glúcido, como por ejemplo las proteínas de membrana.
- Fosfoporteínas, si están unidas a un grupo fosfato, como la caseína de la leche o la vitelina de los huevos
- Cromoproteínas, si están unidas a un grupo que les confiere un color característico, como el grupo hemo de la hemoglobina o la clorofila de la cloroproteína.II. ESTRUCTURA
Proteínas globulares:
- Están compuestas por 1 o más cadenas proteicas que confieren a la proteína su forma característicamente redondeada o esférica.
- Suelen tener un carácter relativamente dinámico.
- Suelen ser solubles en medios acuosos.
- Ejemplos: Anticuerpos (Ig), Albúmina, Hb, enzimas….
- Proteínas fibrosas:
- Se trata de 1 o más cadenas polipeptídicas unidas de lo largo de un eje, presentando una estructura relativamente rígida, con elevada resistencia y no solubles.III. NÚMERO DE SUBUNIDADES
Monoméricas:
- La proteína consta de una sola cadena polipeptídica (lisozima). Ejemplo: Mioglobina.
- Oligoméricas:
- 2 o más cadenas polipeptídicas, generalmente un número par.
- Estas cadenas podrán ser iguales o diferentes.
- Cada cadena independiente se denomina protómero o subunidad monómero.IV. FUNCIÓN BIOLÓGICA
Proteínas con actividad catalítica:
- Existen más de 2000.
- LPL, LH, Hexoquinasa.Proteínas de transporte:
- Proteína que transporta distintas sustancias por sangre o a través de la membrana.
- Proteínas de reserva:
- Reserva de aminoácidos o de cualquier sustancia útil.
- Ovoalbúmina (AA)
- Caseína (AA, P)
- Ferritina (Fe)Proteínas contráctiles:
- Proteínas que permiten a la célula moverse o cambiar de forma.
- Tubulina
- Actina
- Miosina
- DineinaProteínas estructurales:
- Aportan resistencia y protección
- Colágeno
- QueratinaProteínas de defensa:
- Se trate de proteína que protegen al organismo:
- Ig (Ac)
- Trombina
- Fibrinógeno
- Venenos
- Toxinas
- Proteínas reguladoras de diversos procesos biológicos:
- Se trata por ejemplo de algunas hormonas proteicas
- Insulina / Glucagón
- Receptores hormonales
- Elementos que actúan sobre la regulación de la expresión génica.- Aparte de estas podemos encontrar otras proteínas que al no ser comunes a la mayoría de organismos no se podrían clasificar en ninguno de los grupos anteriores, como por ejemplo las sustancias anticongelante que tienen algunos peces que viven en climas excesivamente fríos.
Propiedades de las proteínas
- Las propiedades de las proteínas servirán para clasificarlas.
- Posee propiedades ácido - base.
- Tan sólo se pueden ionizar los extremos terminales de las proteínas, al igual que las cadenas laterales.
- La curva de titulación es demasiado compleja de realizar, por lo que el pI es determinado de manera experimental.
- Pueden ser solubles, aunque hay una serie de factores que intervienen en esta capacidad.
- pH
- En su pI la proteína muestra su mínimo de solubilidad.
- Existe pues la posibilidad de precipitar selectivamente las proteínas.
- Se mantiene la configuración nativa.Fuerza iónica
- Al colocar una proteína en una solución con una concentración excesiva de sales, la proteína precipita, de manera que se produce una concentración por salado, ya que la sal secuestra la capa de agua más próxima a la proteína, provocando así que esta precipite.
- En ocasiones una concentración de sales baja puede favorecer la solubilidad de la proteína.
- Se conserva la configuración nativa.Temperatura
- En el intervalo de 0º a 40º la solubilidad aumenta, pero al pasar de los 40º la proteína pierde la configuración nativa.Disolventes orgánicos
- Etanol o acetona (0º C)
- Reducen la solubilidad, provocando la precipitación.
- Se mantiene la configuración nativa.Detergentes
- Se solubilizan las proteínas.
- Algunos detergentes son:
- Tritón X - 100.
- Tween - 20- Se conserva la configuración nativa.
Agentes químicos desnaturalizantes.
- TCA (ácido tricloroacético)
- PCA (ácido perclórico)
- Se pierde la configuración nativa.Estructura de las proteínas
- Tienen un orden jerárquico: 1aria - 2 aria - 3 aria - 4aria
- Cualquier estructura superior a la primaria viene determinada por esta.1. ESTRUCTURA PRIMARIA
- Se trata de la secuencia lineal de aminoácidos.
- Determina tanto la conformación como la configuración de las proteínas.
- Para descubrir la secuencia de la estructura primaria podemos usar dos métodos:
- Directo:
- Separar los residuos de la proteína mediante hidrólisis y analizar los resultados.
- Indirecto:
- Si conocemos la secuencia de ADN o el ARN de la proteína, podemos insertarlo en un plásmido que se insertará a su vez en una bacteria, que irá produciendo proteínas, las cuales podremos analizar.
- Conocer los aminoácidos de la secuencia primaria permite comparar proteínas normales con proteínas mutantes, al igual que podemos comparar proteínas homólogas entre distintas especies y establecer después filogenias entre estas especies.
- Además mediante el conocimiento de secuencia primaria podemos deducir las estructuras más avanzadas.
- En 1953, Sanger realizó la primera secuenciación, de la insulina, una proteína que tiene 5100 aminoácidos.
- Se conocen alrededor de 20.000 proteínas.- La secuencia primaria es constante y específica dentro de cada especie en concreto.
- Una misma proteína de 2 especies diferentes presentará algunos residuos variables, mientras que muchos otros serán totalmente invariables.
- El número de residuos variables es proporcional a la distancia filogenética.
- Mediante la comparación de las secuencias primarias se puede saber además si durante la evolución ha habido duplicaciones, delecciones u otros procesos similares.
- Tomando como ejemplo las proteínas encargadas de transportar oxigeno:
- Mioglobina: se compone sólo de una cadena, y es la encargada de transportar oxigeno en el músculo.
- Hemoglobina: se suele componer de 4 cadenas diferentes 2 a 2.
- La hemoglobina de la lamprea sólo tiene una cadena.
- En ocasiones puede haber a lo largo de la evolución mutaciones que después serán hereditarias que cambian la funcionalidad de la proteína al cambiar un aminoácido polar por otro apolar, como es el caso de la anemia falciforme, que como contrapartida protege de la malaria.2. ESTRUCTURA SECUNDARIA
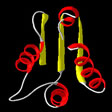
- Es la ordenación regular y periódica de las cadenas polipeptídicas a lo largo de un eje.
- Se estudia mediante la difracción de rayos X en el llamado Roentgenograma.- Astbury, en 1930, descubrió que ciertas proteínas fibrosas presentaban una periodicidad de 0,50 a 0,55 nm, mientras que en otras la periodicidad era de 0,65 a 0,70 nm; esto lo interpretó de manera que supuso que se trataba de proteínas que estaban enrolladas de manera diferente.
- Paulinger y Corey, entre 1940 1950, supusieron, tras estudiar todos los posibles impedimentos estéricos, que el sistema de ordenación para las α - queratinas era la helicoidal → hélice α.
Proteinas fibrosas
α queratinas
Duras: cuernos y uñas
Blandas: pelo, piel,.β queratinas
Seda telarañas, seda capullos, garras, picos y escamasColágeno,..
Hélice α
- Es la cadena polipeptídica enrollada alrededor de un eje imaginario.
- Todas las cadenas laterales están orientadas hacia el exterior.
- El grupo carbonilo de un enlace peptídico establece un puente de hidrógeno con el 4 residuo por delante de él, el 3 enlace peptídico, a nivel del grupo amida.
- Todos los grupos carbonilo están formando puentes de hidrógeno, llamados intracatenarios.
- Queda finalmente una estructura compacta , ya que aunque los puentes de hidrógeno son estructuras débiles, son aditivos y cooperativos.
- Los ángulos dentro de la hélice α son:
- ϕ: -45º / - 50º
- φ: -57º / - 60º
- Cada vuelta de la hélice comprende 3,6 aminoácidos, que abarcan 5,4 Å. La distancia entre 2 Cα consecutivos es de 1,5 Å, y la anchura de la cadena es de 5 Å.
- La hélice α puede ser o bien levógira o bien dextrógira y puede estar formada por D o L aminoácidos.
- Las hélices α naturales son todas dextrógiras y formadas por aminoácidos L.
- No todos los aminoácidos pueden formar hélices α, ya que hay algunos que las desestabilizan y hay otros que la rompen.
- Paulinger y Corey establecieron la teoría de que las α queratinas formaban hélices dextrógiras, y que la subunidad básica es la protofibrilla, que está unida por puentes disulfuro, de manera que tres protofibrillas juntas forman una superhélice levógira.
- Las superhélices son levógiras y están estabilizadas por las fuerzas de Van der Waals.
- Para unir las distintas protofibrillas, las fuerzas que intervienen son las de los puentes disulfuro intercatenarios.
- Las α queratinas son insolubles, ya que poseen grupos mercapto -SH, y sólo algunos organismos como las polillas pueden digerirlos, ya que poseen enzimas específicos.Fuerzas intermoleculares
Puentes de hidrógeno
Interacciones que se producen entre grupos OH y otros grupos como NH.Fuerzas de Van der Waals
Son interacciones intermoleculares entre átomos no cargados. Se trata pues de fuerzas electrostáticas transitorias, que pueden ser tanto atractivas como repulsivas, y sólo afectan a distancias de entre 3 y 4 Å.Fuerzas hidrofóbicas
Tendencia de las cadenas no polares a replegarse hacia el interior de la proteína.Fuerzas electrostáticas
Interacciones entre cargas: F= (Q x Q´) / d2Puentes de disulfuro
Conformación β
- La cadena polipeptídica se extiende a lo largo de un eje, con las amidas y los carbonilos situados de manera casi perpendicular al eje de la cadena polipeptídica y en posición trans.
- Se formarán pues puentes de hidrógeno intercatenarios entre las distintas cadenas.
- Todos los enlaces peptídicos intervienen en la formación de estos enlaces.
- La estructura resultante recibe el nombre de lámina β o lámina plegada, de la que existen 2 tipos distintos:
- Antiparalelo:
- Las cadenas polipeptídicas van en dirección contraria.
- φ: -129º
- ϕ: +125º
- Los Cα se sitúan en las aristas, habiendo 3,5Å de separación entre Cα contiguos.
- En los planos de la lámina β están los puentes de H y los enlaces peptídicos.
- Las cadenas laterales se sitúan hacia delante y hacia atrás de la lámina.
- Paralelo:
- Está más plegada de manera que sólo hay 3,25 Å de separación entre los carbonos contiguos.
- φ: -119º
- ϕ: +113º
- La cadena antiparalela es más estable, porque sus puentes de hidrógeno están situados de manera más perpendicular al eje de la lámina.
- En la lámina β no se producen puentes disulfuro transversales.
- Puede ocurrir que la lámina β se pliegue dando como resultado el giro revertido o giro en horquilla o giro β.
- Existen estructuras superiores que no tienen sólo carácter estructural, sino también funcional; se las conoce como estructuras supersecundarias.
- Se tiende siempre a esconder las cadenas laterales hidrofóbicas.
- Estructura del colágeno
- Es una proteína fibrosa que encontramos en el tejido conjuntivo.
- Forma aproximadamente el 75 % del total de proteínas del organismo.
- Aunque suele formar fibrillas, su forma concreta de pende de la función del tejido.
- Por ebullición del colágeno se obtiene una mezcla peptídica, cuya composición viene a ser:
- 35 % Gly
- 12 % Pro
- 11 % Ala
- 9 % HOPro (Hidroxiprolina)
- Por difracción de rayos X se observa que no presenta ni hélice α ni lámina β.
- El tropocolágeno está unido por un puente covalente de deshidroxinorleucina.
- Al observar con detenimiento la molécula de tropocolágeno encontramos que se trata de un superhélice de 3 hélices.- Mientras que la superhélice es dextrorrotatoria, las hélice que la componen son levorrotatorias.
- Cada vuelta de una de estas hélices es de 3 residuos y las secuencias más comunes son:
- Gly - Pro - X
- Gly - X - Pro
- Gly - X- HOPro
- Con el tiempo aumentan las cantidad de enlaces transversales y disminuyen las características mecánicas del colágeno.
- Podemos encontrar enfermedades que afectan al colágeno.3. ESTRUCTURA TERCIARIA
- Es el modo como la cadena polipeptídica se compacta y se repliega para dar lugar a las proteínas globulares.
- Es la conformación tridimensional de las estructuras secundarias y supersecundarias de las proteínas globulares.
- Se trata de proteínas más dinámicas, más complejas y su roentgenograma es más difícil de interpretar.
- Se produce el replegamiento debido a las fuerzas de hidrofóbicas, mientras que las fuerzas de Van der Waals sirven para estabilizar a la proteína.
- Dentro de la proteína existen diversos fragmentos continuos plegados, que son los llamados dominios estructurales.
- Dentro de la cadena polipeptídica existen fragmentos que tienen una estructura estable y fija, que desempeña una determinada función. Estos dominios proteicos tienen estructuras secundarias y supersecundarias.
- Si se somete a la proteína a proteasas con el fin de separarla, se dividirá en cada uno de sus dominios.
- Ejemplo: Mioglobina
- 155 AA
- PM = 16,7 Kd (Kilodaltons)
- Capta el oxígeno de la sangre y lo lleva hasta las mitocondrias de las células musculares.
- Es un monómero y una proteína conjugada cuyo grupo prostético es un hemo ferroporfirínico.
- Presenta 8 secciones en hélice α, que tienen cada una entre 7 y 23 AA, lo que representa el 80 % del total de la proteína.
- Presenta 7 codos, que está formados por:
- 4 codos por prolina
- Serina
- Treonina
- Asparagina
- Los AA polares están dirigidos hacia el exterior de la proteína.
- Los AA no polares están dirigidos hacia el interior.
- Hay 2 AA polares que están dirigidos hacia el interior:
- His 64
- His 93
- El grupo hemo está situado en una depresión situada entre las hélices 5 y 6.
- La his 93 se une al Fe que se une a su vez al O.
- La his 64 actúa impidiendo que se una CO a la proteína.
- La estructura terciaria es característica de cada proteína globular.
- En diferentes especie será similar, ya que viene determinada por la secuencia lineal de aminoácidos, aunque conociendo la secuencia lineal de aminoácidos, no podemos deducir la estructura terciaria.
- Aminoácidos muy alejados en la secuencia lineal pueden acabar muy próximos en la terciaria.4. ESTRUCTURA CUATERNARIA
- Hace referencia a la interacción entre las cadenas polipeptídicas de los distintos monómero de la proteína oligomérica.
- Las fuerzas electrostáticas los mantienen unidos.
- Las proteínas oligoméricas está formadas por una cantidad par de grupos.- Ejemplo: Hemoglobina
- 55 nm de diámetro, está formada por 4 cadenas polipeptídicas diferentes 2 a 2:
- Hay 2 cadenas α, que se componen de 141 aminoácidos y están codificadas en un gen, y hay 2 cadenas β que se componen de 143 aminoácidos y están codificadas por un gen diferente.
- Cada cadena presenta su propio grupo hemo.
- La unión del O2 a un grupo provoca un aumento del número de posibilidades de unión de otro grupo al oxigeno.
- Este efecto se llama cooperativo, ya que al oxidarse se produce un cambio en la estructura que provoca un acercamiento.
- Conformación nativa:
- Conformación de la proteína en su estado natural y a pleno rendimiento, es decir, en su forma más estable.
- Sin embargo, si la sometemos a condiciones extremas, la proteína puede sufrir un proceso de desnaturalización, lo que provoca una pérdida de función.
- Los enlaces peptídicos se mantienen si se pasa por un proceso de desnaturalización, sólo se pierden las estructuras más avanzadas.
- Casi todas las proteínas globulares pueden pasar por este proceso, aunque las proteínas pueden recuperar tanto su estructura como su función, es decir, renaturalizarse, ya que la información para el correcto plegamiento se halla en la estructura primaria.
- Pero hay proteínas que pueden ayudar a estabilizar y plegar a otras, como es el caso de las chaperoninas o de las heat shock proteins.

















Comentarios