Enzimas
-
Enzimas
Nomenclatura y clasificación de los enzimas
Existen más de 2000 enzimas diferentes.
- Se han tenido que clasificar siguiendo unos criterios unificados, establecidos por la Enzyme Comission International Union of Biochemistry and Molecular Biology (ECIUBMB).
- Ejemplos:
- Arginasa - arginina
- Ureasa - Urea
- Lipasa (Triacilglicérido hidrolasa)
- Pepsina o Tripsina (Proteasas)
- Existen 6 clases principales de enzimas, dentro de las cuales podemos encontrar subclases y clases inferiores, todo esto acompañado por un número de clasificación.
- Ejemplo:
EC 3.1.1.34 → LPL → lipoproteína lipasa.
- El nombre sistemático, que se usa en publicaciones, describe la reacción sobre la que actúa el enzima.Poder catalítico de los enzimas
Como catalizadores:
- Aceleran la velocidad de las reacciones.
- Son eficaces en pequeñas cantidades.
- Su estado inicial es igual a su estado final.
- No alteran el equilibrio de las reacciones que catalizan.
- No afectan a la ΔGComo proteínas:
- Son termolábiles, es decir, son sensibles a la temperatura
- Son más eficientes que los catalizadores químicos.
- Son muy específicos.
- Su regulación es muy compleja.
- La especificidad reside en unos aminoácidos específicos, que conforman 2 centros diferentes:
- El centro catalítico y el centro de unión al sustrato, que conjuntamente conforman el centro activo.Especificidad de acción
- Reside como ya hemos comentado en el centro activo del enzima, ya que el centro activo es el auténtico responsable de la interacción.
- A finales del siglo XIX, Fischer desarrolló el sistema de la llave cerradura para tratar de explicar el funcionamiento concreto de los enzimas a nivel de su especificidad
- En 1963, Koschland propuso el sistema del ajuste inducido, de manera que se supone que el sustrato no es homólogo con el centro activo, sino que la fuerza del enlace provoca una alteración del enzima para poder acoplarse y dar lugar al complejo Enzima - Sustrato.
- La especificidad de los enzimas es tan elevada e nivel de reconocimiento enzima y sustrato, que son capaces de reconocer las formas D y L.
- En el centro catalítico están los grupos implicados directamente en la catálisis, es decir, que son los encargados de la rotura de enlaces y de la formación de nuevos.
- Podemos encontrar tantos centro de unión como sustratos intervengan en la reacción, ya que estos centros son los encargados de reconocer y unirse a los sustratos.
- Los dos centros, es decir, el catalítico y el de unión, suelen hallarse muy unidos, de manera que llegan incluso a solaparse. Si se produce esa unión, se crea el llamado centro activo.
- La estructura y la funcionalidad de los enzimas depende de la correcta estructuración de la proteína.Un enzima puede estar unido a coenzimas o cofactores.
- Si ΔG < 0, este hecho nos indica que la reacción puede ser posible termodinámicamente.
- La velocidad dependerá por lo tanto de diversos factores cinéticos como la frecuencia de los choques entre las moléculas de sustrato y enzima.
- La frecuencia depende de las concentraciones de A y de B.- El % de colisiones efectivas es lo que se conoce como la energía libre de activación; ΔG*.
- Esa energía es la diferencia entre la energía de los reactivos y la energía que deben alcanzar para poder transformarse en los productos. El máximo de la curva recibe el nombre de complejo activado o estado de transición.- Cuanto mayor sea la ΔG de activación menor posibilidad tendrá la reacción de tener lugar.
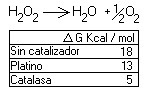
- Se puede aumentar la velocidad aumentando la temperatura, de manera que al aumentar 10º la temperatura se duplica la velocidad, pero la célula carece de este sistema, ya que ella no puede aumentar su temperatura tanto, ya que ello podría conllevar la desnaturalización de algunas proteínas.- Las células usan los biocatalizadores para rebajar la energía libre de activación, de manera que la actuación de los enzimas no afecta al equilibrio, ni a la ΔG asociada, sino única y exclusivamente a la energía de activación. Acelera la reacción gracias a su especificidad.
- Ejemplo:Factores que afectan a los enzimas
- La actividad o velocidad enzimática está definida como la aparición de producto o desaparición de reactivo por unidad de tiempo.
- Existen diversos factores que afectan a esa velocidad que son:
- pH
- La curva de la velocidad en función del pH suele tener una forma acampanada de manera que podemos encontrar un pH al cual en enzima actúa con el máximo de efectividad, que es lo que se conoce como el pH óptimo.
- Hay enzimas que no tienen una forma acampanada, por lo que no tienen un pH óptimo.Temperatura
- Suelen presentar sus máximos de actividad entre los 40º y los 45º.
- A temperaturas mayores se produciría una desnaturalización, mientras que a menores temperaturas lo que sucedería sería que no habría suficiente energía de activación.
- Hay excepciones como es el caso de las bacterias termófilas, que pueden actuar hasta a 85º.
- Las concentraciones de enzima y de sustrato también influyen en la velocidad.
- La fuerza iónica también influye.
- La presencia de cofactores influye también en la velocidad de reacción.
- Si el sustrato es muy pequeño son los coenzimas los que ayudan al reconocimiento.Actividad catalítica de los enzimas
- Es necesario que el sustrato tenga una orientación adecuada, de manera que el enlace del sustrato se pueda romper.
- Al aumentar la concentración aumentarán los choques eficientes.
- El enzima provoca presiones y tensiones en el enlace para provocar su rotura.
- Creación de microambientes
- Pueden crear alrededor del centro activo un ambiente hidrofóbico con diferentes propiedades a los de las proteínas en solución acuosa, de manera que podemos encontrar en él residuos polares que adquieren de esa manera características especiales, como una elevada afinidad por el sustrato.
- En el centro activo no podemos encontrar agua a no ser que participe en la reacción.Catálisis covalente
- Hay enzimas que pueden llegar a formar un complejo covalente enzimas - sustrato, que es muy inestable y favorece de esa manera la formación de los productos correspondientes, reduciendo de esa manera la energía de activación.
- Se nombran según el residuo capaz de formar el enlace.Catálisis ácido - base
- Los aminoácidos son anfólitos, y los enzimas al ser proteínas compuestas por estos tienen algunas capacidades ácido - base, lo que les permite durante su ciclo catalítico actuar o bien como ácido, bien como base, o como ambos.COFACTORES
- Son compuestos no proteicos, de los que necesitan algunos enzimas para poder realizar su función catalítica.
- Holoenzima: Complejo enzima cofactor
- Apoenzima: grupo proteico del enzima
- Iones metálicos: han de ser aportados con la dieta. Pueden ser: Fe, Cu, Zn, Mn, Co, Se, Na, K, Mg,…
- Coenzimas: Son moléculas orgánicas esenciales, que también han de entrar con la dieta. Se suele tratar de vitaminas insolubles como: B1, B2, B3, B6, B12,…Si es un grupo prostético está unido a la parte proteica por un enlace covalente.
- Si se trata de un cosustrato el enlace será débil.
- Puede ocurrir que necesiten más de un cofactor.
- Puede ser difícil distinguir si se trata de un grupo prostético o de un cosustrato.
- Los cofactores ayudan al enzima:
- Favoreciendo la correcta alineación.
- Aportando un sitio adicional de enlace.
- Participando en la catálisis.Los Coenzimas:
- No son proteicos
- Orgánicos, con un peso molecular bajo.
- Termoestables
- Estequiometría.
- No son específicos.
- Tienen diferentes estructura a la de los sustratos.
- Elevada movilidad de electrones.
- Ejemplos:- NAD+: Nicotinamidaadeninnucleótido (Forma reducida del NADH)
- NADP+: Nicotinamidaadeninnucleótidofosfato (Forma reducida del NADPH)
- Se denominan nucleótidos de la piridina o coenzimas piridínicos.
- Nicotinamida: deriva de la vitamina P.P. (Preventivo de la pelagra).
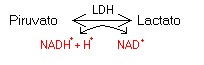
- Es el grupo prostético de algunas Deshidrogenasas (DH):
- IsocitratoDH
- PiruvatoDH
- LactatoDHNucleótidos de la flavina o coenzimas flavínicos.
- Son derivados de la vitamina B2 o rivoflavina.
- Es el grupo prostético de las flavoproteínas o de las flavinDH.
- Se trata del FAD o del FMN
- La parte reactiva es la del anillo de isoaloxacina.
- Puede tener 2 etapas de reducción:- FAD → FADH- → FADH2
- Actúa como coenzima en algunas reaccione como la catalizada por la succinatoDH.





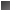












October 5th, 2010 at 10:58 pm
es bueno