Cinética enzimática
-
Cinética enzimática
Permite:
 - Distinguir unos enzimas de otros.
- Distinguir unos enzimas de otros.
- Distinguir entre isoenzimas.
- Conocer las diferencias entre la actividad en un tejido o en otro.
- Permite conocer su afinidad con el sustrato.
- Las unidades de actividad enzimática se miden siempre a pH óptimo, a T óptima y con concentraciones de sustrato saturantes, midiéndose por lo tanto la actividad enzimática en la cantidad de sustrato desaparecida por unidad de tiempo.
- La unidad internacional es: μmol S /min.; siempre en condiciones estándar de 25º C, pH óptimo y [S] saturante.
- Existen además otras unidades de diversa utilidad:
- Nº de recambio o actividad molecular: (nº mol S /s) /molec. E.Catal o Katal: mol S /s
Actividad específica (AE): nº mol E /g. prot (o) Katales/g prot
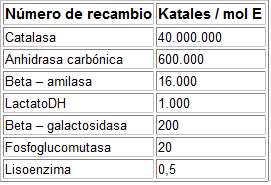
Las reacciones se pueden seguir o bien siguiendo la aparición de productos o bien la desaparición de sustratos.- Según va aumentando el tiempo, la velocidad disminuye porque:
- El producto actúa como un inhibidor
- Se va alcanzando el equilibrio
- Se sustrato se va acabando
- Teóricamente la V0 es tangente a la curva, pero empíricamente es difícil de calcular.
- Órdenes de reacción:
- Reacción de orden 1: la velocidad depende directamente de la concentración del sustrato
- Reacción de orden mixto: la velocidad no depende directamente de la concentración del sustrato
- Reacción de orden 0: la velocidad no depende de la concentración del sustratoPostulado de Henri
- Se llega a la velocidad máxima de la reacción cuando el enzima está saturado por el sustrato. Esta velocidad se puede aumentar aumentando la concentración del enzima.
- Km es aquella concentración de sustrato que da una velocidad inicial igual a la mitad de la velocidad máxima
- La Km muestra una medida de la afinidad del enzima por el sustrato, de manera que a mayor afinidad menor Km, y viceversa.
- La Km depende de la temperatura, de la fuerza iónica y del pH, pero es independiente de la concentración de enzima.
- La Kcat es igual al número de recambio, aunque también se la conoce como constante catalítica, y es el número máximo de moléculas de sustrato convertidas a producto por centro activo y segundo cuando todo el enzima está saturado, es decir, está formando el complejo activo E - S.
- Los enzimas no suelen trabajar a su Vmax.
- Para poder calcular la Vmax debemos realizar cambios en la ecuación para que de una ecuación lineal.Reacciones bisustrato
Mecanismo secuencial
- Ambos sustratos deben encontrarse simultáneamente en el centro activo para poder formar el complejo terciario ESS.
- Puede ser de 2 tipos:
- Ordenado:
- Existe una secuencia establecida de entrada de los sustratos y de salida de los productos.
- Azar:
- No existe una secuencia obligatoria.
Mecanismo Ping - Pong
- Tenemos en principio el enzima libre que se activa con el primer sustrato, formando el primer producto, quedando modificado temporalmente el enzima que reacciona con el segundo formando un nuevo producto y quedando el enzima inmodificado.
- No existe la formación del complejo terciario.
- La secuencia de entrada de productos está establecida.Inhibición
- La mayoría de los enzimas pueden ser inhibidos.
- El estudio de los enzimas y sus posibles inhibiciones permite estudiar farmacoterapia, rutas metabólicas,…Inhibición Irreversible
- El inhibidor se combina o destruye algún grupo vital para que el enzima desarrolle correctamente su función, con lo que el enzima queda totalmente inutilizado.
- Ejemplos:
- DFP (gas nervioso)- Inhibidor de la acetilcolinesterasa.
- Provoca una parálisis que conlleva la muerte.
- El DFP se une a un residuo de serina a nivel del OH
- Este gas permitió el desarrollo de un insecticida, el malatión.Inhibición reversible
- Se puede usar Michaelis - Menten para estudiar estos tipos de inhibición.
- Podemos encontrar de diversos tipos:COMPETITIVA:
- El inhibidor y el sustrato compiten por el mismo centro, ya que ambas moléculas tienen estructuras similares, que les permiten unirse al mismo centro, de manera que el inhibidor impide que se una el sustrato.
- Al competir tenemos las siguientes consecuencias:
- Se necesita más cantidad de sustrato para llegar a la Vmax.
- Se necesita más sustrato para llegar a la Km, que pasa a ser la Kmap (aparente).
- Existe ahora una constante de disociación, la llamada Ki.- Para combatir la inhibición una solución es aumentar la concentración de sustrato.
NO COMPETITIVA:
- El inhibidor no se une al centro activo, sino que se une a otro lugar, donde puede alterar la estructura del enzima, impidiendo la formación del complejo ES o del producto.
- La Km no varía con el incremento de la concentración, mientras que lo que sí varía es la Vmax, que pasará a ser aparente.ACOMPETITIVA:
- El inhibidor no se combina con el Enzima sino que se une al complejo enzima - sustrato (ES), formando el complejo Enzima - Sustrato - Inhibidor (ESI).
- Se suele dar en reacciones bisustrato.
- Tendremos una velocidad máxima aparente menor y una Km aparente menor.
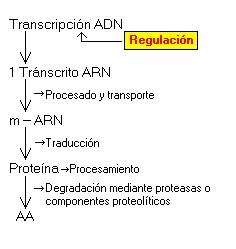
- El inhibidor se une según se va uniendo el sustrato.Regulación de la actividad enzimática
Es una manera de regular la actividad metabólica.
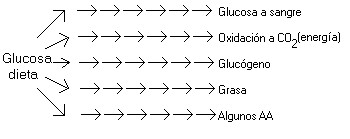
Rutas metabólicas de la Glucosa
- Existen mecanismos homeostáticos para controlar los productos, de manera que el sustrato inicial no siempre genera la misma cantidad de productos.
- Algunas vías pueden estar desconectadas en función de las necesidades del organismo.
- La regulación de una determinada vía metabólica puede venir determinada por la presencia de un enzima limitante.
- Puede tratarse de una regulación a largo plazo si se controla la cantidad de enzima, y de una a corto plazo si se trata de una regulación realizada con moduladores o efectores, que pueden o bien favorecer o bien perjudicar a la reacción.
- La expresión del enzima puede ser regulada por medio de factores hormonales que impiden la expresión de un determinado gen que exprese el enzima que se busca reprimir.
- La variación de la cantidad de enzima vendría dada en ese caso por la diferencia entre las velocidades de síntesis y de degradación.
- Esa diferencia se llama “turnover” o velocidad de recambio.
- La célula conoce el número de moléculas que se deben sintetizar.
- Ejemplos: E. Coli.
- E. Constituyentes; se forman a cantidad y velocidad constante, independientemente del estado metabólico del individuo.
- E. Inducibles; se forman en cantidades muy pequeñas, pero su cantidad puede aumentar enormemente en presencia del sustrato, y todavía más si ese determinado sustrato es su única fuente de sustrato.- Al igual que existe la inducción, podemos encontrar la represión.
- Jacob y Monod desarrollaron el modelo del operon lac.
- En eucariotas el proceso de regulación a largo plazo puede ser mucho más complicado.
- La regulación en eucariotas se produce mediante hormonas que regulan la expresión del gen. En vertebrados, los puntos de regulación están en el punto donde se produce el primer contacto con los nutrientes.- Los mecanismos de regulación a corto plazo no implican un cambio en la síntesis del enzima.
- Existen factores limitantes a la actividad enzimática, que pueden ser la temperatura, el pH, la concentración de sustrato, o la presencia de cofactores.
- Hay otros enzimas que tienen otras propiedades que les permiten regular el metabolismo, son los enzimas reguladores, que son relativamente complejos.
- Tienen algún mecanismo en su estructura que les permite regular la actividad ya sea de manera reversible o irreversible.
- Son los responsables de las alteraciones metabólicas en células y tejidos, en tiempos relativamente cortos, ya sean segundos o minutos, dependiendo si se trata de no covalentes o de covalentes.Regulación no covalente
- El caso más sencillo es el de la retroinhibición o “feed - back” negativo.
- Una vez sintetizado suficiente producto, este mismo actúa de inhibidor sobre el enzima, impidiendo la síntesis de un exceso de producto.
- Otro mecanismo no covalente es el alosterismo.
- A mediados de los 50 se observó que había enzimas que no seguían la ecuación de Michaelis - Menten.
- Esto se debe a que Michaelis - Menten supusieron que la entrada de sustratos a los enzimas se producía de manera simultánea, cuando en realidad, en ocasiones la entrada del sustrato a un enzima puede favorecer la entrada del sustrato a otro enzima, aumentando la afinidad del enzima por el sustrato.
- El fenómeno por el que la entrada de moléculas de sustrato aumenta la afinidad se denomina cooperatividad, y se da en enzimas oligoméricos, con estructura cuaternaria.
- Si no se trata de oligómeros, no se podrá producir cooperatividad.
- Esta cooperatividad puede ser o bien positiva, si aumenta la afinidad o bien negativa, si disminuye la afinidad.
- Si se estudiasen cada una de las subunidades del oligómero por separado, entonces sí se seguiría la cinética de Michaelis - Menten.
- Al realizar la linealización, se distingue claramente un enzima cooperativo de otro que no lo sea.
- La cooperatividad de los enzimas representa claramente una ventaja evolutiva, ya que con mismas concentraciones de sustrato tendremos un aumento de V mayor que con enzimas no cooperativos.
- Es el propio sustrato el que hace de modulador, es lo que se denomina control homotrópico.
- Si el enzima está regulado por otros compuestos, entonces se conoce como control heterotrópico.
- Tanto moduladores como efectores pueden actuar como activadores o inhibidores, recibiendo distintos nombres si se trata de un único el que actúa sobre un enzima, siendo este el caso de los monovalentes, o si se trata de más de uno, siendo este el caso de los polivalentes.
- La regulación es factible porque los enzimas poseen centros independientes para los moduladores, que son diferentes del centro activo.
- Por eso reciben el nombre de enzimas alostéricos, ya que “alos” quiere decir “otro lugar”.
- Se cree que la unión del modulador al enzima hace alterarse la estructura del enzima, provocando así un cambio en la afinidad.
- Este tipo de inhibición es diferente a la estudiada en Michaelis - Menten.
- Tanto la activación como la inhibición son reversibles y no covalentes.
- Los enzimas alostéricos son en su mayoría oligoméricos.
- Los enzimas K varías su K0,5, pero no su Vmax; mientras que los enzimas V varían la Vmax, pero no alteran la K0,5.Regulación covalente
IRREVERSIBLE
- Algunos enzimas son sintetizados en una forma inactiva, denominada proenzima o zimógeno.
- En estas formas inactivas el centro activo no puede ser alcanzado por el sustrato, por lo que el enzima es inactivo.
- Se alcanza la forma activa mediante la rotura de algunos enlaces peptídicos mediante la acción de algunos enzimas proteolíticos.
- Se trata pues de un proceso posttraduccional.
- En todos los casos el paso de proenzima a la forma activa del enzima conlleva cambios en la estructura primaria del enzima, debido a la rotura de algunos enlaces peptídicos, lo que finalmente conlleva cambios a nivel de las demás estructuras.
- Ejemplo:
- El pepsinógeno se encuentra en su forma inactiva en el estomago, de manera que a pH ácido se rompe un enlace peptídico y se forma el enzima activo.
- Este tipo de regulación es covalente e irreversible.REVERSIBLE
- Existen formas tanto activas como inactivas del enzima, que pueden ser interconvertidas mediante modificaciones covalentes de sus estructuras.
- Las modificaciones suelen ser llevadas a cabo por otros enzimas.
- La activación y la desactivación en cascada permiten la amplificación de la señal por pequeña que esta sea.- Una modificación típica suele ser la fosforilación del enzima, aunque el hecho de tener un enzima fosforilado no implica que esta sea su forma activa.
- Se trata de modificaciones covalentes pero reversibles.- Existen otro tipo de factores que afectan a la eficiencia catalítica:
- Isoenzimas:
- Se trata de enzimas de diferentes estructuras y diferentes propiedades cinéticas, que catalizan la misma reacción.
- Otro método de regulación es mediante la existencia de complejos multienzimáticos, en los que varios enzimas se reúnen en una entidad de un orden superior para dar lugar a una estructura llamada complejo. Estos enzimas tendrán que ser de la misma cadena metabólica. Este sistema tiene diversas ventajas:
- Menor tiempo de transición.
- No se liberan metabolitos intermedios.
- Con la presencia de un regulador se regula todo.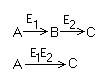
- Ejemplos:
- PyrDH: 3E
- AGsintetasa: 7E
- Otro método para regular es el conocido como compartimentación.
- Este proceso regula la actividad metabólica separando el sustrato de los enzimas que actuarán sobre él.
- En las vías metabólicas las vías de síntesis y de degradación están separadas, de manera que siempre están separado el enzima y el sustrato.
- Existen varios sistemas para permitir el paso del sustrato cuando se le necesite al lugar donde está el enzima.
- Sistema lanzadera:
- Se convierte el sustrato en una sustancia que pueda atravesar la membrana, para reconvertirlo una vez la haya atravesado.
- Ejemplo:
- El Oxalacetato (OAA) no puede pasar a través de la membrana mitocondrial a no ser que se transforme, ya sea en malato, citrato o aspartato.
- Una vez ha pasado la membrana, vuelve a transformarse en OAA
- Sistemas de transporte:
- Dentro de los sistemas de transporte podemos encontrar como el más sencillo el que se conoce como difusión simple, ya que se produce a favor del gradiente.
- Otro sistema es el que se conoce como la difusión facilitada, mediante un transportador, que en ocasiones puede llegar a saturarse. Este transporte permite el paso de moléculas polares grandes, sin carga. Siempre es a favor del gradiente, hasta que se igualan concentraciones. No implica ningún coste de energía por parte de la célula.
- Podemos distinguir 3 tipos generales de transporte:
- Uniporte: 1 molécula en 1 sentido.
- Simporte: 2 moléculas en el mismo sentido.
- Antiporte: 2 moléculas en sentidos contrarios.
- Aportando energía obtendremos lo que se conoce como transporte activo, que suele ser en contra del gradiente de concentración.
- Podemos distinguir 2 tipos de transporte, si este implica gasto de energía, aparte de los anteriormente citados:
- Transporte activo primario:
- Si la energía es aportada directamente por:
- Hidrólisis de ATP.
- Flujo de electrones en una cadena de cadena de transporte de e-.
- Luz.
- Transporte activo secundario:
- Si la energía es creada por un gradiente de concentración creado a su vez por un transporte activo primario, de manera que este crea un gradiente que al descargarse permite el paso de otra sustancia.





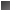


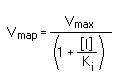










Comentarios